ホルマリン中で長期保存したプランクトンの群集組成の復元に成功
2021年2月18日
東京大学 大気海洋研究所
海洋研究開発機構
豊橋技術科学大学

発表のポイント
◆長期にわたって生体試料を保存するために自然科学・医学など多くの分野でホルマリンが用いられているが、ホルマリンで保存された試料からのDNA抽出は困難であるという見解が一般的であり、これら試料のDNA情報の利用はほとんど進んでいない。
◆本研究で、ホルマリン中に長期保存された試料からDNAを抽出しプランクトン群集組成を復元する手法の開発に成功した。
◆本手法を多くの研究機関・博物館等に保管されている歴史的試料に応用することで、環境変動にプランクトン群集がどのように応答してきたかが明らかになると期待される。
発表者
塩崎 拓平(東京大学大気海洋研究所 准教授 / 海洋研究開発機構 地球環境部門 外来研究員)
広瀬 侑 (豊橋技術科学大学 応用化学・生命工学系 助教)
小野寺 丈尚太郎(海洋研究開発機構 地球環境部門 北極環境変動総合研究センター 主任研究員)
桑田 晃 (水産研究・教育機構 水産資源研究所 寒流第2グループ 主幹研究員)
原田 尚美(海洋研究開発機構 地球環境部門 地球表層システム研究センター センター長)
発表概要
プランクトン試料は世界中の海洋や湖沼において100年以上前から日常的に採取されており、生体部分が分解しないよう、ホルマリン溶液に入れて研究室や博物館に保管されています(例: 図1)。これらホルマリン溶液に保存された試料は当時のDNA情報を保持しており、この情報を利用することができれば環境変動に対するプランクトン群集組成の変化や種自体のゲノム変化などを調べることができるようになり、様々な研究への応用が期待されます。しかし、ホルマリンによって形成される分子間の強い結合(メチレン架橋)のために、ホルマリンで保存された試料からのDNA抽出は困難であるという見解が一般的であり、これら試料のDNA情報の利用はほとんど進んでいません。
東京大学と海洋研究開発機構、豊橋技術科学大学、水産研究・教育機構の共同研究チームは、ホルマリン固定試料からDNAを抽出する手法を最適化し、抽出したDNAからプランクトン群集を網羅的に復元できることを明らかにしました。
プランクトン群集は海洋や湖沼生態系の中で最も低次に位置する群集であり、近年の環境変動の影響を最も強く受けていると考えられます。しかし、プランクトン群集を網羅的に調べることを目的とした(つまりDNA採取を目的とした)モニタリングは、近年になってようやくいくつかの定点観測点で始まったばかりです。世界各地で採取、保管されてきたホルマリン試料に本手法を用いれば、環境変動に対するプランクトン群集の応答の理解が一気に進むと期待されます。これは本手法の応用例の一例ですが、他にも絶滅種のゲノム復元や進化研究など歴史的試料を用いた様々な研究展開が期待されます。
発表内容
ホルマリン(約37%のホルムアルデヒド溶液と定義される)は100年以上前から医学や基礎生物学、環境学など様々な分野で細胞固定液として使用されてきました。ホルマリン固定試料からDNAを抽出できれば、過去に採取された試料からゲノム情報を得ることが可能になります。しかし、ホルマリン固定試料からのDNA抽出はホルマリン固定されていない試料からのDNA抽出に比べて非常に困難であるという認識が一般的です。ホルマリン固定によってDNAを含む分子間にメチレン架橋が形成されます。この架橋構造が長期間の有機物の保存を可能にしているのですが、DNAを抽出する場合はまずこの架橋を取り外す必要があります。
博物館や研究室に長期にわたって保管されているホルマリン固定試料からのDNA抽出の試みは近年になってから始まりました。これまでのところ、長期間保管されたホルマリン固定試料からでもDNAの抽出が可能であることは明らかになっています。しかしその試みのほとんどは単一種を対象としたものに留まっていること、またDNA抽出法自体が最適化されていないという問題がありました。本研究が対象としたのは真核プランクトン群集全体です。海洋学や湖沼学の分野ではプランクトンネットやマリンスノーを捕集するセジメントトラップ、プランクトンレコーダー等を用いてプランクトン群集を採取し、それをホルマリンで固定して保存することが日常的に行われています(例: 図1)。これまでこれらの試料の群集は、主に顕微鏡を用いて形態的特徴から解析されてきました。しかし、近年のDNA情報を用いた研究によって、ほとんどのプランクトン群集は形態的特徴から推定できないほど多様であることが明らかになっています。そのため、プランクトン群集の真の多様性を知るためにはDNA情報を引き出すことが必要不可欠です。ホルマリン固定プランクトン試料からムラなくDNAが抽出できれば、より網羅的に過去に採取されたプランクトン群集組成が復元できることになります。
本研究では様々な条件を検討した結果、DNA抽出液にホウ酸バッファー(pH 11)、SDS、Proteinase Kを加え、長時間高温状態を維持することで、ホルマリンでできたメチレン架橋を効果的に外しDNAを抽出できることを明らかにしました。そして本手法を用いて17年間ホルマリン溶液に保存されたセジメントトラップ試料のDNAを抽出したところ、そこから復元された珪藻群集が顕微鏡で観察された珪藻群集とよく一致することがわかりました(図2)。また全真核プランクトン群集の復元可能性を調査するために、海水試料をホルマリン固定しないで直ちにDNAを抽出した系と、ホルマリン固定して1.5年間保管した後DNAを抽出した系の真核植物プランクトン群集の違いを調べました。その結果、試料採取後直ちにDNA抽出を行なったサンプルとホルマリン固定し1.5年間保管した試料とでプランクトン群集に違いはなく、長期間ホルマリン保存したプランクトンサンプルでもこの手法を用いることで、群集が網羅的に復元できることを明らかにしました(図3)。
本手法は、環境変動がプランクトン群集に与える影響を調査する上で画期的なものとなる可能性があります。プランクトン群集は海洋や湖沼生態系の中で最も低次に位置する群集であり、環境変化の影響を大きく受けます。しかし、プランクトン群集の解析を対象としたDNA採取は一部の定点観測点で近年になってから観測が始まったばかりです。そのため、人間活動に伴う環境変動や気候変動がプランクトン群集にどのような影響を及ぼしているのかは、ほとんどわかっていない状況であり、近年になってこの問題が研究者間で共有されるに至っています(注1)。プランクトンは生食食物連鎖の底辺の支え手であると同時に海洋物質循環に密接に関わっています。そのため、プランクトン群集組成の変化は生態系全体の機能に影響を及ぼします。プランクトン群集試料は、上記で述べたように世界各地で長年にわたって採取され、ホルマリン固定されて保存されてきました。これら歴史的試料中に含まれるDNAを本手法を用いて調べることで、近年の環境変化がプランクトン群集に及ぼす影響を全球的に理解することができる可能性があります。
本研究には、JSPS科研費JP15H05712, JP16H01599, JP19H05667と北極域研究推進プロジェクト(ArCS)、北極域研究加速プロジェクト(ArCSII)の交付を受けて行った研究の成果が含まれています。
発表雑誌
雑誌名:「PLOS ONE」
論文タイトル:A DNA metabarcoding approach for recovering plankton communities from archived samples fixed in formalin
著者:Takuhei Shiozaki*et al.
DOI番号:https://doi.org/10.1371/journal.pone.0245936![]()
アブストラクトURL:
https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0245936![]()
問い合わせ先
東京大学大気海洋研究所 微生物分野
准教授 塩崎 拓平(しおざき たくへい)
E-mail:shiozaki◎g.ecc.u-tokyo.ac.jp ※アドレスの「◎」は「@」に変換してください
注釈
注1 Cavicchioli et al. (2019) Scientists’ warming to humanity: microorganisms and climate change, Nature review microbiology, 17, 569-586.
添付資料

図1: プランクトンネットで採取されホルマリン固定された試料
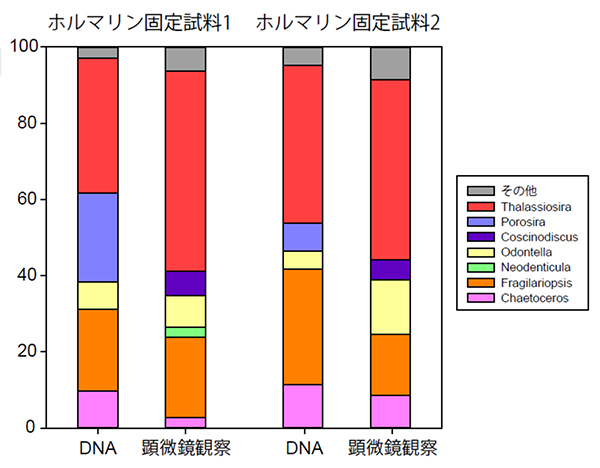
図2: 17年間ホルマリン固定された試料中の珪藻群集のDNA解析結果と顕微鏡観察結果の比較
全珪藻群集中0.5%以上の存在量となった属のみを示す。PorosiraとCoscinodiscusは形態が似ているため、顕微鏡での識別ミスもしくはDNAデータベース上のミスが考えられた。
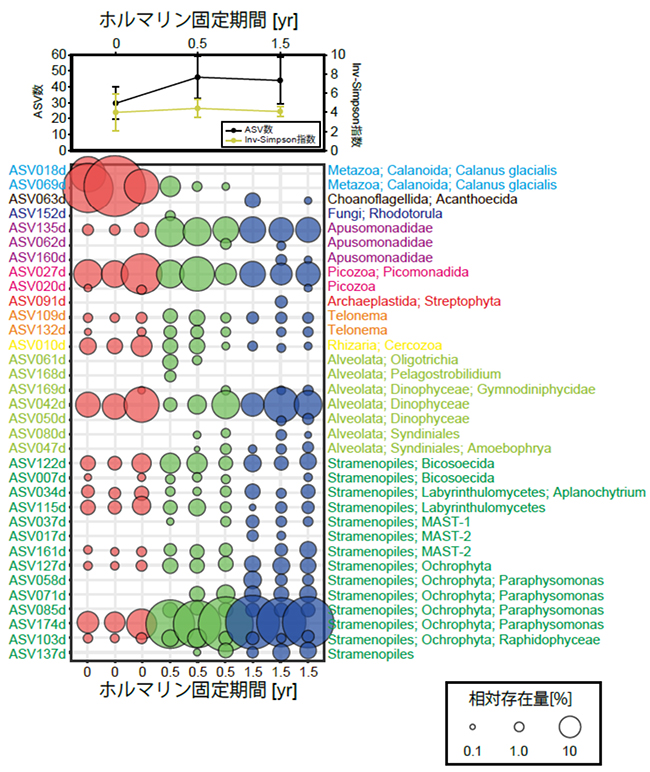
図3:ホルマリン固定期間の異なる試料のASV数、Inv-Simpson指数、群集組成
群集組成は全群集の0.5%以上の存在量となるもののみを示している。
![]()

 教職員募集
教職員募集 所内専用
所内専用
